حل اسئلة تقويم الهيدروكربونات
1. اكتب الصيغة البنائية لكل من المركبات التالية، ثم أكتب الإسم الصحيح منها تبعًا لنظام الإيوباك.
. -3- بنتن
. -3- برومو بروبان
. -1,1- ثنائي ميثيل إيثين
. -2- إيثييل -3- ميثيل بيوتان
2. أي الصيغ الاتية تمثل الكانات أو الكينات أو الكاينات أو الكانات حلقية.
C40H82-C4H10-C6H12-C5H12-C3H8
3. اكتب الصيغ البنائية التالية بطريقة صحيحة:
a.
b.
c.
d.
e.
4. أكتب الصيغ البنائية للمركبات الاتية:
. 3- ميثيل -1- بنتين
. 4- بروبيل -2- هبتين
. 4- ميثيل -1- هكسين
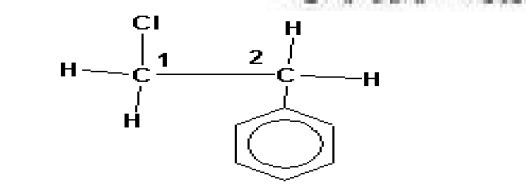
. 1- كلورو -2- فينيل ايثان
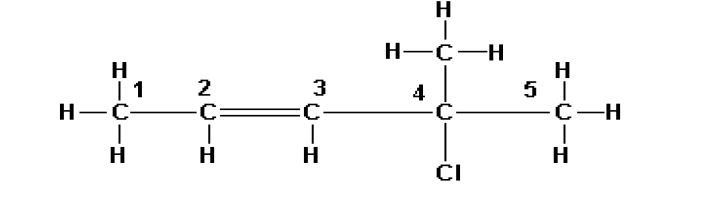
. 4 كلورو -4- ميثيل -2- بنتين
5. أكتب الصيغة البنائية للهيدروكربونات الآتية:
a. هيدروكربون غير حلقی به ست ذرات كربون وأثنان من الروابط المزدوجة.
يتكون أحد الصيغ التالية:
b. هيدروكربون غير حلقی به ست ذرات كربون وثلاث روابط ثلاثية.
c. هيدروكربون غير حلقی به خمس ذرات كربون ورابطة مزدوجة واحدة.
يتكون أحد الصيغ التالية:
dـ - هيدروكربون حلقی به خمس ذرات كربون وكل الروابط فيه أحادية.
6. أي التفاعلات الآتية يعتبر تفاعل إضافة؟
C4H8(g)+Cl2C4H8cl(g)
اضافة
C7H16(l)C7H8(l)+4H2(g)
نزع
C6H6(l)+C2H5cl(l)+4C8H10(l)+Hcl(g)
إستبدال
C3H6(g)+cl2(g)+4C3H6cl2(g)
إضافة
7. يمكن تحضير البنزين من الهكسان العادي بإمراره على عامل حفز في درجة حرارة مرتفعة بطريقة تسمى إعادة التشكيل. ماهو الألكان الذي يمكن استخدامه لتحضير الطولوين بهذه الطريقة؟
الحل:
C7H16 هبتان
أو 2- ميثيل - هكسان
8. ما عدد مولات الهيدروجين اللازمة للتفاعل مع واحد مول مما ياتي:
a.
b.
c.
الحل:
9. ما المواد اللازمة لتحضير كل مما يأتي:
10. ارسم الصيغة البنائية للمونومرات اللازمة لتحضير البوليمترات الاتية:
11. ارسم الثلاثة وحدات المتكررة الأولى لبوليمرات الأضافة للمونومرات الاتية:
-
الايثين
-
2.1- ثنائي كلورو ايثين
-
2- مثيل 1 بروبين
12. اكتب اسماء المركبات الاتية بنظام الايوباك:
1.
1- هكساين
2.
3- ايثيل -1- هكساين
3.
4- ميثيل -2- هكساين
4.
1- كلورو -4- نيترو بنزين
5.
1- كلورو -3- نيترو بنزين
6.
(3،1 ) ثنائي برمو بنزين
7.
(2،1) ثنائي كلورو بنزين
8.
(4,2) ثنائي برومو-1- كلورو-بنزين
9.
10.
(4،2) ثنائي فينيل - بنتان
11.
2- فينيل-بيوتان
13. علل
a. وفرة المركبات العضوية.
- قدرة ذرات الكربون علي الارتباط التساهمي مع بعضها او مع غيرها من الذرات بروابط عديدة فقد ترتبط بروابط احادية او ثنائية او ثلاثية.
- قدرة ذرات الكربون علي الارتباط التساهمي مع بعضها بطرق مختلفة اما علي هيئة سلاسل مستمرة او سلاسل متفرعة او حلقات متجانسة او غير متجانسة.
b. الصيغة البنانية أفضل من الصيغة الجزيئية.
لسببين:
- الصيغة البنانية توضح عدد ونوع الذرات وطريقة الترابط بينهم في جزيء المركب بينما الصيغة الجزيئية توضح نوع وعدد الذرات فقط.
- الصيغة البنائية تعبر عن مركب عضوي واحد فقط بينما الصيغة الجزيئية تعبر عن اكثر من مركب عضوي ( المشابه الجزيئية ).
c. الألكانات مركبات مشبعة بينما الألكينات غير مشبعة.
الالكانات مركبات مشبعة لان جميع الروابط في السلسلة الكربونية احادية من النوع سيجما اما الالكينات غير مشبعة لان السلسلة الكربونية تحتوي على رابطة مزدوجة واحدة على الاقل احداهما سيجما والأخرى باي بين ذرتين کربون.
14. اشرح الخطوات التي تجربها للكشف عن عنصري الهيدروجين والكربون في مركب عضوي مع كتابة معادلات التفاعل رمزية ومتزنة؟
للكشف عن عنصري الهيدروجين والكربون في المركب العضوي:
تحرق المادة العضوية (بلاستيك أو قماش) مع أكسيد نحاس وتمرر الغازات الناتجة على كبريتات نحاس بيضاء وماء جير رائق.
الفكرة:
يعتمد هذا الكشف على أكسدة الكربون والهيدروجين في المادة العضوية بأكسيد النحاس الأسود فيتحول الكربون إلى ثاني أكسيد الكربون والهيدروجين إلى ماء.
المشاهـدة:
1. تزرق كبريتات النحاس
2. تعكر ماء الجير الرائق الاستن
الاستنتاج:
1. زرقة كبريتات النحاس دليل تكون الماء لذا نستنتج أن المادة العضوية بها هيدروجين
2. تعكر ماء الجير دليل تكون ثاني أكسيد الكربون لذا نستنتج أن المادة العضوية تحتوى على الكربون.
15. كيف يحضر غاز الميثان في المعمل. أرسم الجهاز المستخدم وأكتب معادلة التفاعل.
يحضر الميثان في المعمل بالتقطير الجاف لملح اسيتات الصوديوم اللامائية مع الجير الصودي:
16. وضح كيف يحضر غاز الابثين في المعمل مع رسم الجهاز المستخدم وكتابة معادلة التفاعل.
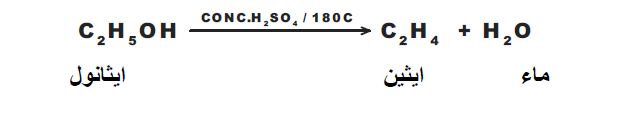
ينزع الماء من الكحول الايثيلي (الايثانول) بواسطة حمض الكبريتيك المركز الساخن عند 180 درجة مئوية.
الجهاز المستخدم:
معادلة التحضير وخطواتها:
تفسير التفاعل: التفاعل يتم في خطوتين متتاليتين (استبدال ثم نزع).
1. يتفاعل الايثانول مع حمض الكبريتيك المركز عند 80 درجة مئوية ووتتكون كبريتات الايثيل الهيدروجينية ويتم التفاعل بالاستبدال:
2. تنحل كبريتات الايثيل الهيدروجينية بالحرارة (تحلل حراري) ويتون الايثين (تفاعل نزع).
17. أشرح تأثير غاز الإيثين على:
1. محلول البروم
يرج غاز الايثين مع البروم الأحمر المذاب في رابع كلوريد الكربون يزول لون ماء البروم الأحمر ويتكون (1و2) ثنائي برومو ايثان عديم اللون:
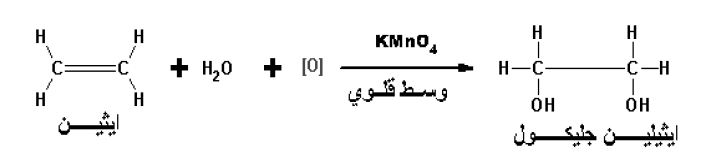
2. محلول برمنجنات البوتاسيوم ( في وسط قلوی )
امرار غاز الايثين في محلول برمنجات البوتاسيوم بنفسجية في وسط قلوي يزول لون برمنجات البوتاسيوم يتكون الايثيلين جليكول عديم اللون ايضًا.
18. كيف تحصل على الايثانال (الاسيتالدهيد ) من الايثاين؟
19. أشرح تفاعل الايثين مع كل من المركبات الآتية:
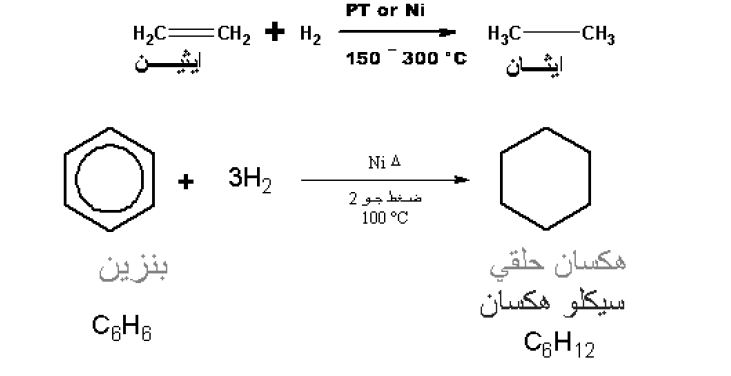
الهيدروجين
هدرجة الايثين تعطي ايثان
البروم المذاب في رابع كلوريد الكربون
مع ماء البروم الاحمر يزيل اللون
هاليد الهيدروجين
تنكسر الرابطة باي وتضاف ذرة الهيدروجين الى احد ذرتي كربون الرابطة المزدوجة وتضاف ذرة الهاليد X الى ذرة الكربون اخرى.
20. كيف يحضر البنزين من بنزوات الصوديوم؟ أكتب معادلة التفاعل.
تحضر بتفاعل بنزوات الصوديوم بتفاعل التعادل : حمض البنزويك مع هيدروكسيد الصوديوم التالي:
21. صف ما يحدث في كل من الحالات الآتية موضحًا الظروف اللازم توافرها لإتمام التفاعل.
a. هدرجة البنزين في وجود عامل حفاز
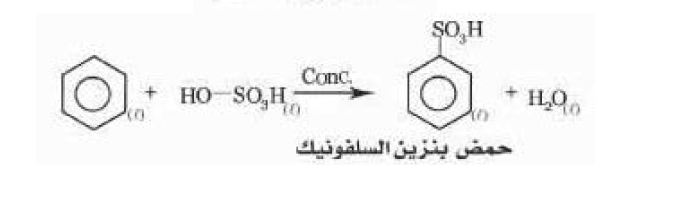
b. سلفنة البنزين.
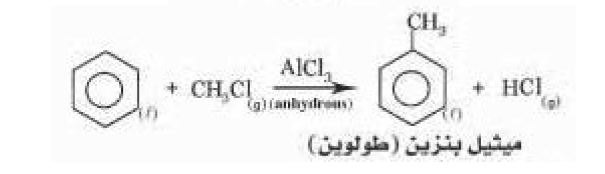
c. الحصول على الطولوين من البنزين.
22. أكتب معادلات رمزية تمثل التفاعلات الآتية:
1. تفاعل إضافة.
توجد امثلة متعددة للاضافة تفاعل الايثين والايثاين كلها اضافة البنزين ايضًا يتفاعل بالاضافة.
إضافة هاليد الهيدروجين Hx.
تنكسر الرابطة باي وتضاف ذرة الهيدروجين (الشق الموجب) إلى ذرة الكربون الغنية بالهيدروجين وتضاف ذرة الهاليد (الشق السالب) الى الكربون الفقيرة بالهيدروجين وتسمى هذه القاعدة بقاعدة ماركينكوف:
2. تفاعل بلمرة بالإضافة.
3. تفاعل نزع
نزع الماء من الكحول الايثيلي (الايثانول) بواسطة حمض الكبريتيك المركز الساخن عند 180 درجة مئوية:
تنحل كبريتات الايثيل الهيدروجينية بالحرارة (تحلل حراري) ويتكون الايثين (تفاعل نزع)
4. تفاعل هيدرة حفزية
الهيدرة الحفزية للايثين (إماهه الايثين) إضافة الماء للايثين.
5. تفاعل تكسير حفزي حراری
تكسير الاوكتان: ينتج بيوتان وبيوتين
6. تفاعل أكسدة
تتأكسد الالكينات بالعوامل المؤكسدة: مثل فوق أكسيد الهيدروجين H2O2 وبرمنجنات البوتاسيوم القلوية البنفسجية KMno4 وتتكون الجليكولات (كحولات ثنائية الهيدروكسيل)
تفاعل أكسدة الالكينات الى جليكولات يعتبر تفاعل اضافة امرار غاز الايثين في محلول برمنجنات بوتاسيوم بنفسجية في وسط قلوي يزول لون برمنجات البوتاسيوم ويتكون الايثيلين جليكول عديم اللون ايضًا.
7. تفاعل إحلال
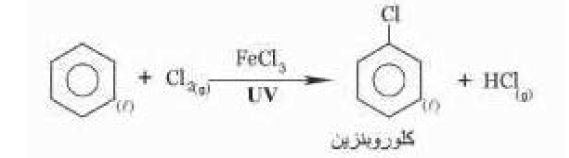
هلجنة الميثان تفاعل احلال ويتفاعل البنزين بالاستبدال
مثال أخر تفاعل استبدال البنزين:
8. تفاعل فريدل - گرافت
9. تفاعل باير
إمرار غاز الايثين في محلول برمنجات بوتاسيم بنفسجية في وسط قلوي يزول لون برمنجات البوتاسيوم يتكون الايثيلين جليكول عديم اللون ايضًا.
10. تفاعل سلفنة
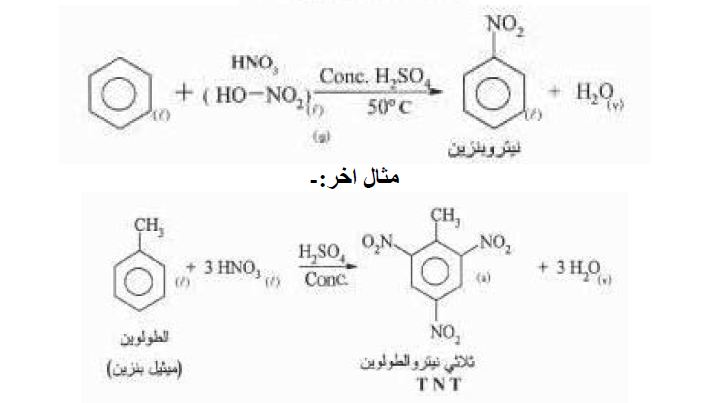
11. تفاعل نيترة
12. تفاعل هلجنة
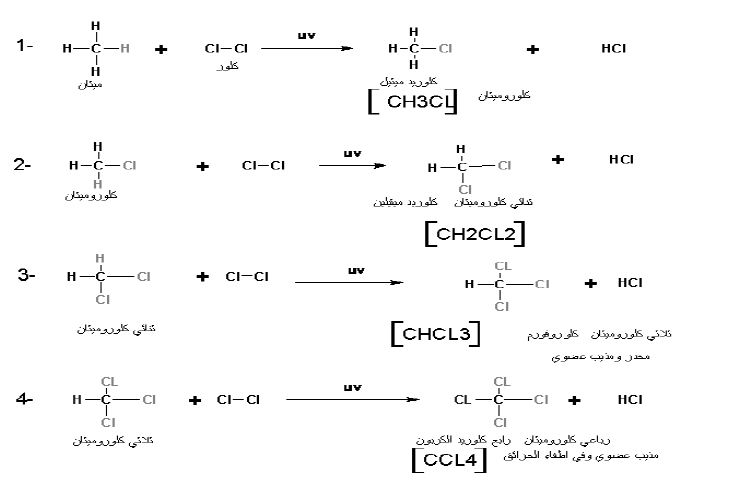
هلجنة الميثان وهلجنة الايثين والايثاين والبنزين
13. تفاعل هدرجة
هدرجة الايثين و الايثاين والبنزين
14. تفاعل نزع للماء
نزع الماء من الكحول الايثيلي (الايثانول) بواسطة حمض الكبريتيك المركز الساخن عند 180 درجة مئوية.

.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
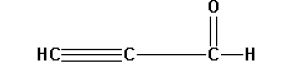
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)
.JPG)